-
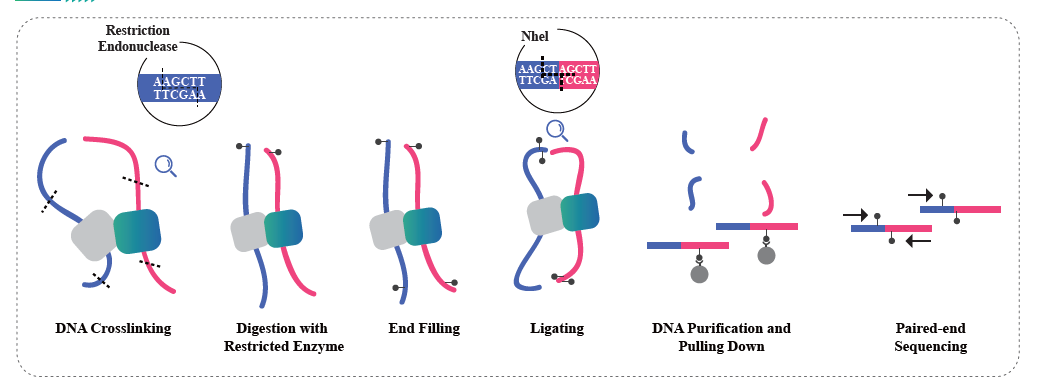
Interakcja chromatyny oparta na Hi-C
Hi-C to metoda zaprojektowana do przechwytywania konfiguracji genomu poprzez połączenie sondowania interakcji opartych na bliskości i sekwencjonowania o wysokiej przepustowości. Metoda opiera się na sieciowaniu chromatyny formaldehydem, a następnie trawieniu i ponownej ligacji w taki sposób, że tylko fragmenty połączone kowalencyjnie utworzą produkty ligacji. Dzięki sekwencjonowaniu tych produktów ligacji możliwe jest badanie organizacji 3D genomu. Hi-C umożliwia badanie rozmieszczenia części genomu, które są lekko upakowane (kompartmenty A, euchromatyna) i z większym prawdopodobieństwem są aktywne transkrypcyjnie, oraz regionów, które są mocniej upakowane (przedziały B, heterochromatyna). Hi-C można również wykorzystać do wskazania domen powiązanych topologicznie (TAD), regionów genomu, które mają złożoną strukturę i prawdopodobnie mają podobne wzorce ekspresji, a także do identyfikacji pętli chromatyny, regionów DNA zakotwiczonych razem przez białka i które są często wzbogacane o elementy regulacyjne. Usługa sekwencjonowania Hi-C firmy BMKGene umożliwia badaczom badanie przestrzennych wymiarów genomiki, otwierając nowe możliwości zrozumienia regulacji genomu i jej konsekwencji dla zdrowia i chorób.
-
Sekwencjonowanie immunoprecypitacji chromatyny (ChIP-seq)
Immunoprecypitacja chromatyny (CHIP) to technika wykorzystująca przeciwciała do selektywnego wzbogacania białek wiążących DNA i odpowiadających im celów genomicznych. Jego integracja z NGS umożliwia profilowanie całego genomu celów DNA związanych z modyfikacją histonów, czynnikami transkrypcyjnymi i innymi białkami wiążącymi DNA. To dynamiczne podejście umożliwia porównanie miejsc wiązania w różnych typach komórek, tkankach lub stanach. Zastosowania ChIP-Seq obejmują badanie regulacji transkrypcji i ścieżek rozwojowych po wyjaśnianie mechanizmów chorobowych, co czyni go niezbędnym narzędziem do zrozumienia krajobrazów regulacji genomu i pogłębiania wiedzy terapeutycznej.
Platforma: Illumina NovaSeq
-
Sekwencjonowanie wodorosiarczynem całego genomu (WGBS)
Sekwencjonowanie wodorosiarczynem całego genomu (WGBS) to złoty standard metodologii dogłębnego badania metylacji DNA, w szczególności piątej pozycji w cytozynie (5-mC), kluczowym regulatorze ekspresji genów i aktywności komórkowej. Zasada leżąca u podstaw WGBS obejmuje obróbkę wodorosiarczynem, indukującą konwersję niemetylowanych cytozyn do uracylu (C do U), pozostawiając niezmienione metylowane cytozyny. Technika ta zapewnia rozdzielczość jednozasadową, umożliwiając naukowcom kompleksowe badanie metylomu i odkrywanie nieprawidłowych wzorców metylacji związanych z różnymi schorzeniami, zwłaszcza rakiem. Stosując WGBS, naukowcy mogą uzyskać niezrównany wgląd w krajobrazy metylacji całego genomu, zapewniając szczegółowe zrozumienie mechanizmów epigenetycznych leżących u podstaw różnorodnych procesów biologicznych i chorób.
-
Test na chromatynę dostępną dla transpozazy z sekwencjonowaniem o dużej przepustowości (ATAC-seq)
ATAC-seq to wysokoprzepustowa technika sekwencjonowania stosowana do analizy dostępności chromatyny w całym genomie. Jej zastosowanie zapewnia głębsze zrozumienie złożonych mechanizmów globalnej kontroli epigenetycznej nad ekspresją genów. Metoda wykorzystuje hiperaktywną transpozazę Tn5 do jednoczesnej fragmentacji i znakowania otwartych regionów chromatyny poprzez wstawienie adapterów sekwencjonowania. W wyniku późniejszej amplifikacji PCR powstaje biblioteka sekwencjonowania, która pozwala na kompleksową identyfikację otwartych regionów chromatyny w określonych warunkach czasoprzestrzennych. ATAC-seq zapewnia całościowy obraz dostępnych krajobrazów chromatyny, w przeciwieństwie do metod, które skupiają się wyłącznie na miejscach wiązania czynników transkrypcyjnych lub określonych regionach zmodyfikowanych histonami. Sekwencjonując te otwarte regiony chromatyny, ATAC-seq ujawnia regiony, w których istnieje większe prawdopodobieństwo aktywnych sekwencji regulatorowych i potencjalnych miejsc wiązania czynników transkrypcyjnych, dostarczając cennych informacji na temat dynamicznej modulacji ekspresji genów w genomie.
-
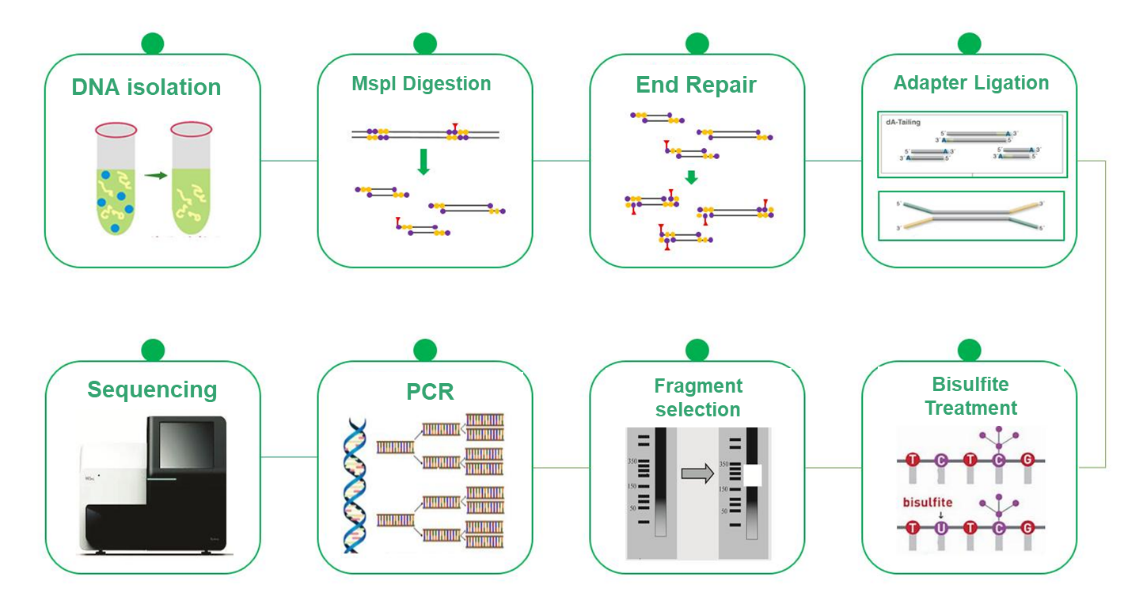
Sekwencjonowanie wodorosiarczynem o zmniejszonej reprezentacji (RRBS)
Sekwencjonowanie wodorosiarczynem o zmniejszonej reprezentacji (RRBS) okazało się opłacalną i wydajną alternatywą dla sekwencjonowania wodorosiarczynem całego genomu (WGBS) w badaniach nad metylacją DNA. Chociaż WGBS zapewnia kompleksowe spostrzeżenia poprzez badanie całego genomu w rozdzielczości pojedynczej zasady, jego wysoki koszt może być czynnikiem ograniczającym. RRBS strategicznie łagodzi to wyzwanie poprzez selektywną analizę reprezentatywnej części genomu. Metodologia ta opiera się na wzbogacaniu regionów bogatych w wyspy CpG przez rozszczepienie MspI, a następnie selekcję wielkości fragmentów o wielkości 200-500/600 bps. W rezultacie sekwencjonowaniu podlegają tylko regiony położone najbliżej wysp CpG, podczas gdy te z odległymi wyspami CpG są wykluczane z analizy. Proces ten, w połączeniu z sekwencjonowaniem wodorosiarczynem, pozwala na wykrywanie metylacji DNA z wysoką rozdzielczością, a metoda sekwencjonowania, PE150, koncentruje się w szczególności na końcach wstawek, a nie na środku, zwiększając skuteczność profilowania metylacji. RRBS jest nieocenionym narzędziem umożliwiającym opłacalne badania nad metylacją DNA i pogłębiającym wiedzę na temat mechanizmów epigenetycznych.