-
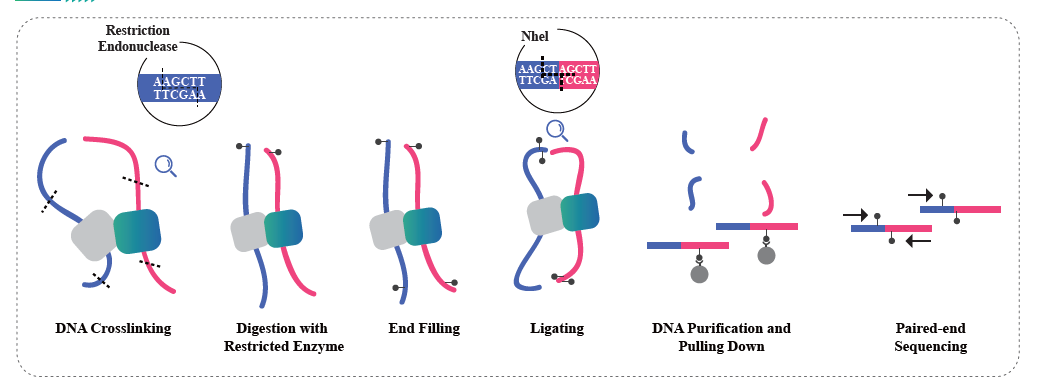
Hi-Cベースのクロマチン相互作用
Hi-C は、プロービング近接ベースの相互作用とハイスループット シーケンスを組み合わせてゲノム構成を捕捉するように設計された方法です。この方法は、ホルムアルデヒドによるクロマチン架橋に基づいており、その後、共有結合した断片のみがライゲーション産物を形成するような方法での消化と再ライゲーションが続きます。これらのライゲーション産物を配列決定することにより、ゲノムの 3D 構成を研究することができます。 Hi-C を使用すると、軽く詰まっていて転写活性が高い可能性が高いゲノム部分 (A コンパートメント、ユークロマチン) と、より密に詰まっている領域 (B コンパートメント、ヘテロクロマチン) の分布を研究することができます。 Hi-C は、折り畳まれた構造を持ち、同様の発現パターンを持つ可能性が高いゲノム領域であるトポロジー関連ドメイン (TAD) を正確に特定したり、タンパク質によって互いに固定されている DNA 領域であるクロマチン ループを特定したりするためにも使用できます。多くの場合、規制要素が豊富に含まれています。 BMKGene の Hi-C シーケンス サービスを利用すると、研究者はゲノムの空間的側面を探索できるようになり、ゲノム制御とその健康と疾患への影響を理解するための新たな道が開かれます。
-
クロマチン免疫沈降シーケンス (ChIP-seq)
クロマチン免疫沈降 (CHIP) は、抗体を利用して DNA 結合タンパク質とそれに対応するゲノム標的を選択的に濃縮する技術です。 NGS との統合により、ヒストン修飾、転写因子、その他の DNA 結合タンパク質に関連する DNA ターゲットのゲノムワイドなプロファイリングが可能になります。この動的なアプローチにより、さまざまな細胞型、組織、または状態にわたる結合部位の比較が可能になります。 ChIP-Seq の応用範囲は、転写制御および発生経路の研究から疾患メカニズムの解明まで多岐にわたり、ゲノム制御の状況を理解し、治療上の洞察を進める上で不可欠なツールとなっています。
プラットフォーム: Illumina NovaSeq
-
全ゲノム亜硫酸水素塩シーケンシング(WGBS)
全ゲノム亜硫酸水素塩シークエンシング (WGBS) は、DNA メチル化、特に遺伝子発現と細胞活性の極めて重要な調節因子であるシトシンの 5 番目の位置 (5-mC) を詳細に調査するためのゴールドスタンダードの方法論です。 WGBS の基礎となる原理には、亜硫酸水素塩処理が含まれており、メチル化シトシンは変化させずに、非メチル化シトシンのウラシルへの変換 (C から U) を誘導します。この技術は単一塩基の分解能を提供するため、研究者はメチロームを包括的に調査し、さまざまな状態、特に癌に関連する異常なメチル化パターンを明らかにすることができます。 WGBS を採用することで、科学者はゲノム全体のメチル化状況について比類のない洞察を得ることができ、多様な生物学的プロセスや疾患の根底にあるエピジェネティックなメカニズムを微妙に理解することができます。
-
ハイスループットシークエンシングによるトランスポザーゼアクセス可能なクロマチンのアッセイ (ATAC-seq)
ATAC-seq は、ゲノム全体のクロマチン アクセシビリティ分析に使用されるハイスループット シーケンス手法です。これを使用すると、遺伝子発現に対する全体的なエピジェネティックな制御の複雑なメカニズムについてのより深い理解が得られます。この方法では、高活性な Tn5 トランスポザーゼを使用して、シーケンシング アダプターを挿入することにより、開いたクロマチン領域の断片化とタグ付けを同時に行います。その後の PCR 増幅によりシーケンス ライブラリが作成され、特定の時空条件下でオープン クロマチン領域を包括的に同定できます。 ATAC-seq は、転写因子結合部位や特定のヒストン修飾領域のみに焦点を当てる方法とは異なり、アクセス可能なクロマチンランドスケープの全体像を提供します。 ATAC-seq は、これらの開いたクロマチン領域を配列決定することにより、活性な調節配列および潜在的な転写因子結合部位が存在する可能性が高い領域を明らかにし、ゲノム全体にわたる遺伝子発現の動的な調節に関する貴重な洞察を提供します。
-
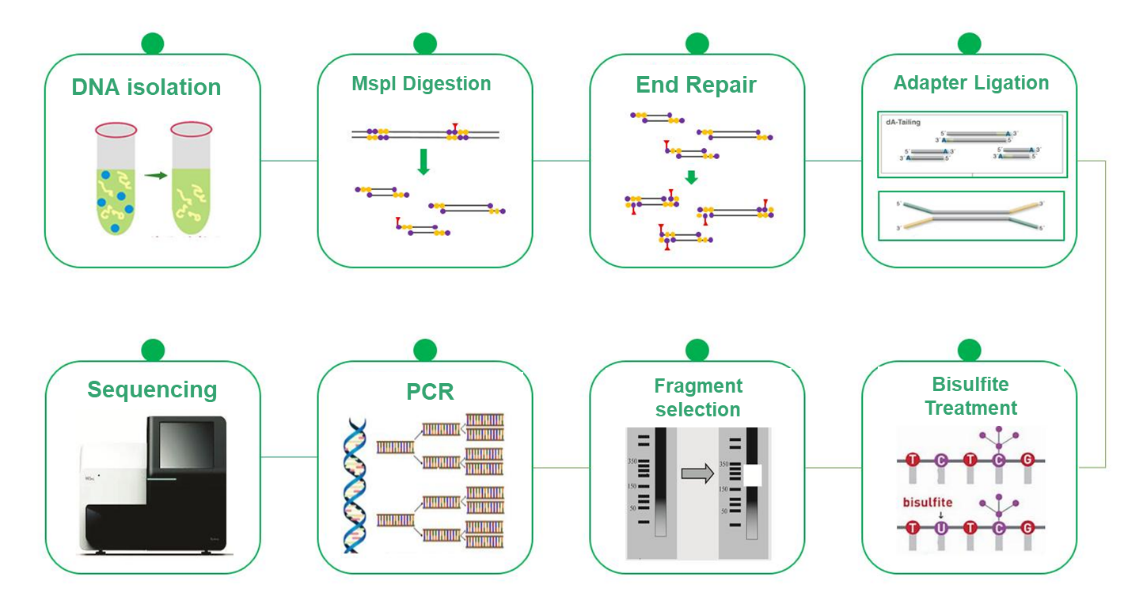
Reduced Representation Bisulfite Sequencing (RRBS)
Reduced Representation Bisulfite Sequencing (RRBS) は、DNA メチル化研究における全ゲノム Bisulfite Sequencing (WGBS) に代わる費用対効果が高く効率的な代替手段として登場しました。 WGBS は単一塩基解像度でゲノム全体を検査することで包括的な洞察を提供しますが、コストが高いことが制限要因になる可能性があります。 RRBS は、ゲノムの代表的な部分を選択的に分析することで、この課題を戦略的に軽減します。この方法論は、MspI 切断による CpG アイランドに富んだ領域の濃縮と、それに続く 200 ~ 500/600 bps フラグメントのサイズ選択に依存しています。したがって、CpG アイランドに近い領域のみが配列決定され、遠く離れた CpG アイランドを持つ領域は解析から除外されます。このプロセスと亜硫酸水素塩シーケンシングを組み合わせることで、DNA メチル化の高分解能検出が可能になり、シーケンシング アプローチである PE150 はインサートの中央ではなく末端に特に焦点を当て、メチル化プロファイリングの効率を高めます。 RRBS は、費用対効果の高い DNA メチル化研究を可能にし、エピジェネティックなメカニズムの知識を進歩させる貴重なツールです。