-
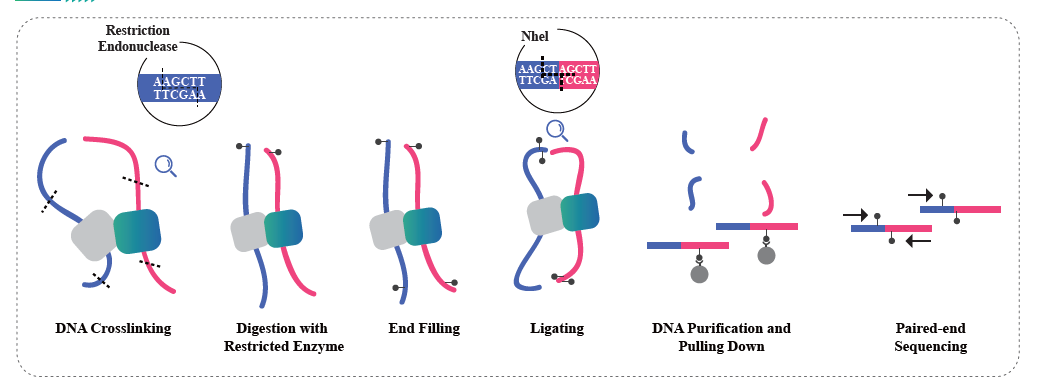
Interaction chromatine basée sur Hi-C
Hi-C est une méthode conçue pour capturer la configuration génomique en combinant le sondage des interactions basées sur la proximité et le séquençage à haut débit. La méthode est basée sur la réticulation de la chromatine avec du formaldéhyde, suivie d'une digestion et d'une religature de manière à ce que seuls les fragments liés de manière covalente forment des produits de ligature. En séquençant ces produits de ligation, il est possible d'étudier l'organisation 3D du génome. Hi-C permet d'étudier la répartition des parties du génome peu compactées (compartiments A, euchromatine) et plus susceptibles d'être transcriptionnellement actives, et des régions plus denses (compartiments B, hétérochromatine). Hi-C peut également être utilisé pour identifier les domaines topologiquement associés (TAD), des régions du génome qui ont des structures repliées et sont susceptibles d'avoir des modèles d'expression similaires, et pour identifier les boucles de chromatine, les régions d'ADN qui sont ancrées ensemble par des protéines et qui sont souvent enrichi d’éléments réglementaires. Le service de séquençage Hi-C de BMKGene permet aux chercheurs d'explorer les dimensions spatiales de la génomique, ouvrant ainsi de nouvelles voies pour comprendre la régulation du génome et ses implications sur la santé et la maladie.
-
Séquençage d'immunoprécipitation de la chromatine (ChIP-seq)
L'immunoprécipitation de la chromatine (CHIP) est une technique qui exploite les anticorps pour enrichir sélectivement les protéines liant l'ADN et leurs cibles génomiques correspondantes. Son intégration avec NGS permet le profilage à l'échelle du génome des cibles d'ADN associées à la modification des histones, aux facteurs de transcription et à d'autres protéines de liaison à l'ADN. Cette approche dynamique permet des comparaisons de sites de liaison entre divers types de cellules, tissus ou conditions. Les applications de ChIP-Seq s'étendent de l'étude de la régulation transcriptionnelle et des voies de développement à l'élucidation des mécanismes de la maladie, ce qui en fait un outil indispensable pour comprendre les paysages de la régulation génomique et faire progresser les connaissances thérapeutiques.
Plateforme : Illumina NovaSeq
-
Séquençage bisulfite du génome entier (WGBS)
Le séquençage au bisulfite du génome entier (WGBS) constitue la méthodologie de référence pour l'exploration approfondie de la méthylation de l'ADN, en particulier la cinquième position dans la cytosine (5-mC), un régulateur essentiel de l'expression des gènes et de l'activité cellulaire. Le principe du WGBS implique un traitement au bisulfite, induisant la conversion des cytosines non méthylées en uracile (C en U), tout en laissant les cytosines méthylées inchangées. Cette technique offre une résolution à base unique, permettant aux chercheurs d'étudier de manière approfondie le méthylome et de découvrir des modèles de méthylation anormaux associés à diverses affections, notamment le cancer. En utilisant le WGBS, les scientifiques peuvent acquérir des informations sans précédent sur les paysages de méthylation à l’échelle du génome, offrant ainsi une compréhension nuancée des mécanismes épigénétiques qui sont à la base de divers processus biologiques et maladies.
-
Test de chromatine accessible à la transposase avec séquençage à haut débit (ATAC-seq)
ATAC-seq est une technique de séquençage à haut débit utilisée pour l'analyse de l'accessibilité de la chromatine à l'échelle du génome. Son utilisation permet de mieux comprendre les mécanismes complexes du contrôle épigénétique global sur l’expression des gènes. La méthode utilise une transposase Tn5 hyperactive pour fragmenter et marquer simultanément les régions ouvertes de la chromatine en insérant des adaptateurs de séquençage. L'amplification PCR ultérieure aboutit à la création d'une bibliothèque de séquençage, qui permet l'identification complète des régions ouvertes de la chromatine dans des conditions spatio-temporelles spécifiques. ATAC-seq fournit une vue holistique des paysages chromatiniens accessibles, contrairement aux méthodes qui se concentrent uniquement sur les sites de liaison aux facteurs de transcription ou sur des régions spécifiques modifiées par des histones. En séquençant ces régions ouvertes de chromatine, ATAC-seq révèle des régions plus susceptibles d'activer des séquences régulatrices et des sites de liaison potentiels aux facteurs de transcription, offrant ainsi des informations précieuses sur la modulation dynamique de l'expression des gènes à travers le génome.
-
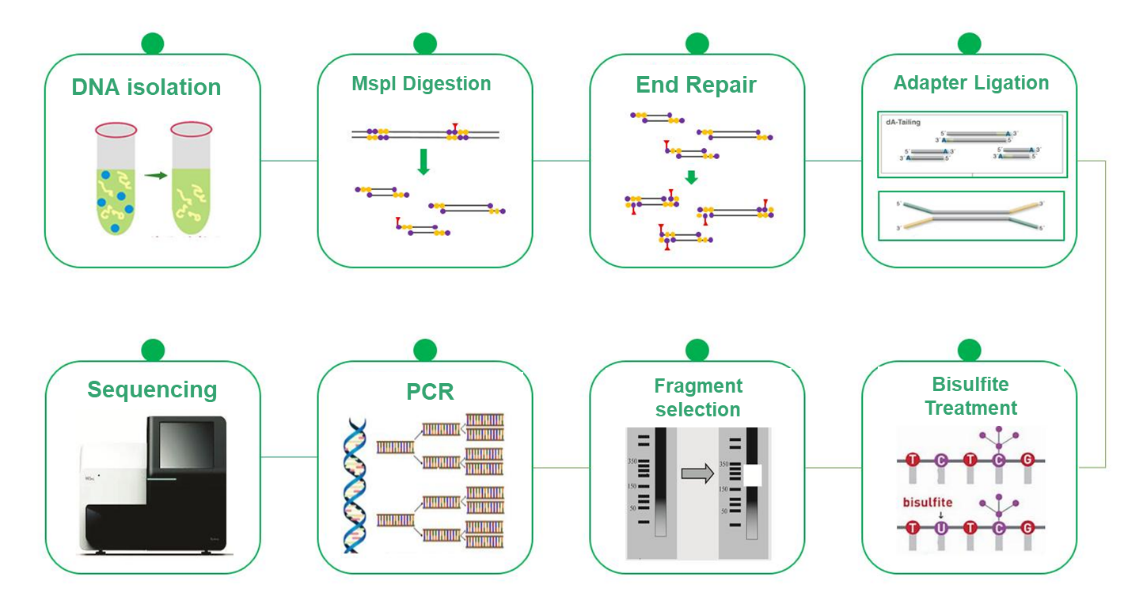
Séquençage du bisulfite à représentation réduite (RRBS)
Le séquençage au bisulfite à représentation réduite (RRBS) est apparu comme une alternative rentable et efficace au séquençage au bisulfite du génome entier (WGBS) dans la recherche sur la méthylation de l'ADN. Bien que le WGBS fournisse des informations complètes en examinant l’intégralité du génome avec une résolution de base unique, son coût élevé peut être un facteur limitant. RRBS atténue stratégiquement ce défi en analysant sélectivement une partie représentative du génome. Cette méthodologie repose sur l'enrichissement des régions riches en îlots CpG par clivage MspI suivi d'une sélection de taille de fragments de 200 à 500/600 pb. Par conséquent, seules les régions proches des îlots CpG sont séquencées, tandis que celles comportant des îlots CpG éloignés sont exclues de l’analyse. Ce processus, combiné au séquençage au bisulfite, permet une détection haute résolution de la méthylation de l'ADN, et l'approche de séquençage PE150 se concentre spécifiquement sur les extrémités des inserts plutôt que sur le milieu, augmentant ainsi l'efficacité du profilage de la méthylation. Le RRBS est un outil précieux qui permet une recherche rentable sur la méthylation de l’ADN et fait progresser la connaissance des mécanismes épigénétiques.