-
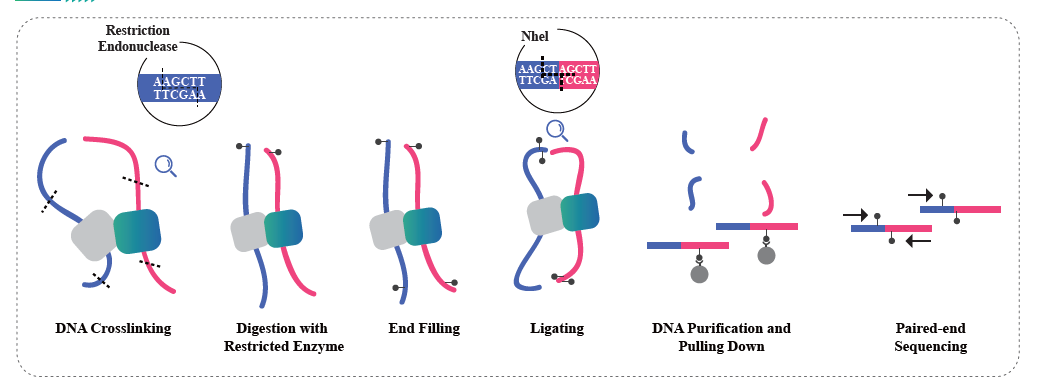
Hi-C-basierte Chromatin-Interaktion
Hi-C ist eine Methode zur Erfassung der genomischen Konfiguration durch die Kombination von Sondierungs-Proximity-basierten Interaktionen und Hochdurchsatzsequenzierung. Die Methode basiert auf der Chromatinvernetzung mit Formaldehyd, gefolgt von der Verdauung und erneuten Ligation, sodass nur kovalent verknüpfte Fragmente Ligationsprodukte bilden. Durch die Sequenzierung dieser Ligationsprodukte ist es möglich, die 3D-Organisation des Genoms zu untersuchen. Hi-C ermöglicht die Untersuchung der Verteilung der Teile des Genoms, die leicht gepackt sind (A-Kompartimente, Euchromatin) und mit größerer Wahrscheinlichkeit transkriptionell aktiv sind, und der Regionen, die dichter gepackt sind (B-Kompartimente, Heterochromatin). Hi-C kann auch verwendet werden, um topologisch assoziierte Domänen (TADs) zu lokalisieren, Regionen des Genoms, die gefaltete Strukturen aufweisen und wahrscheinlich ähnliche Expressionsmuster aufweisen, und um Chromatinschleifen zu identifizieren, DNA-Regionen, die durch Proteine miteinander verankert sind oft angereichert mit regulatorischen Elementen. Der Hi-C-Sequenzierungsdienst von BMKGene ermöglicht Forschern die Erforschung der räumlichen Dimensionen der Genomik und eröffnet neue Wege zum Verständnis der Genomregulation und ihrer Auswirkungen auf Gesundheit und Krankheit.
-
Chromatin-Immunpräzipitationssequenzierung (ChIP-seq)
Chromatin-Immunpräzipitation (CHIP) ist eine Technik, die Antikörper nutzt, um DNA-bindende Proteine und ihre entsprechenden genomischen Ziele selektiv anzureichern. Die Integration mit NGS ermöglicht die genomweite Profilierung von DNA-Zielen, die mit Histonmodifikationen, Transkriptionsfaktoren und anderen DNA-bindenden Proteinen verbunden sind. Dieser dynamische Ansatz ermöglicht den Vergleich von Bindungsstellen über verschiedene Zelltypen, Gewebe oder Zustände hinweg. Die Anwendungen von ChIP-Seq reichen von der Untersuchung der Transkriptionsregulation und Entwicklungspfaden bis hin zur Aufklärung von Krankheitsmechanismen und machen es zu einem unverzichtbaren Werkzeug zum Verständnis genomischer Regulationslandschaften und zur Weiterentwicklung therapeutischer Erkenntnisse.
Plattform: Illumina NovaSeq
-
Bisulfit-Sequenzierung des gesamten Genoms (WGBS)
Whole Genome Bisulfit Sequencing (WGBS) gilt als Goldstandard-Methode für die eingehende Untersuchung der DNA-Methylierung, insbesondere der fünften Position in Cytosin (5-mC), einem zentralen Regulator der Genexpression und Zellaktivität. Das WGBS zugrunde liegende Prinzip umfasst die Behandlung mit Bisulfit, die die Umwandlung nicht methylierter Cytosine in Uracil (C zu U) induziert, während methylierte Cytosine unverändert bleiben. Diese Technik bietet eine Einzelbasenauflösung und ermöglicht es Forschern, das Methylom umfassend zu untersuchen und abnormale Methylierungsmuster aufzudecken, die mit verschiedenen Erkrankungen, insbesondere Krebs, verbunden sind. Durch den Einsatz von WGBS können Wissenschaftler beispiellose Einblicke in genomweite Methylierungslandschaften gewinnen und so ein differenziertes Verständnis der epigenetischen Mechanismen ermöglichen, die verschiedenen biologischen Prozessen und Krankheiten zugrunde liegen.
-
Assay für Transposase-zugängliches Chromatin mit Hochdurchsatzsequenzierung (ATAC-seq)
ATAC-seq ist eine Hochdurchsatz-Sequenzierungstechnik, die für die genomweite Analyse der Zugänglichkeit von Chromatin verwendet wird. Der Einsatz ermöglicht ein tieferes Verständnis der komplexen Mechanismen der globalen epigenetischen Kontrolle der Genexpression. Die Methode nutzt eine hyperaktive Tn5-Transposase, um gleichzeitig offene Chromatinregionen durch Einfügen von Sequenzierungsadaptern zu fragmentieren und zu markieren. Durch anschließende PCR-Amplifikation entsteht eine Sequenzierungsbibliothek, die eine umfassende Identifizierung offener Chromatinregionen unter spezifischen Raum-Zeit-Bedingungen ermöglicht. ATAC-seq bietet eine ganzheitliche Sicht auf zugängliche Chromatinlandschaften, im Gegensatz zu Methoden, die sich ausschließlich auf Transkriptionsfaktor-Bindungsstellen oder spezifische Histon-modifizierte Regionen konzentrieren. Durch die Sequenzierung dieser offenen Chromatinregionen deckt ATAC-seq Regionen mit höherer Wahrscheinlichkeit für aktive regulatorische Sequenzen und potenzielle Transkriptionsfaktor-Bindungsstellen auf und bietet wertvolle Einblicke in die dynamische Modulation der Genexpression im gesamten Genom.
-
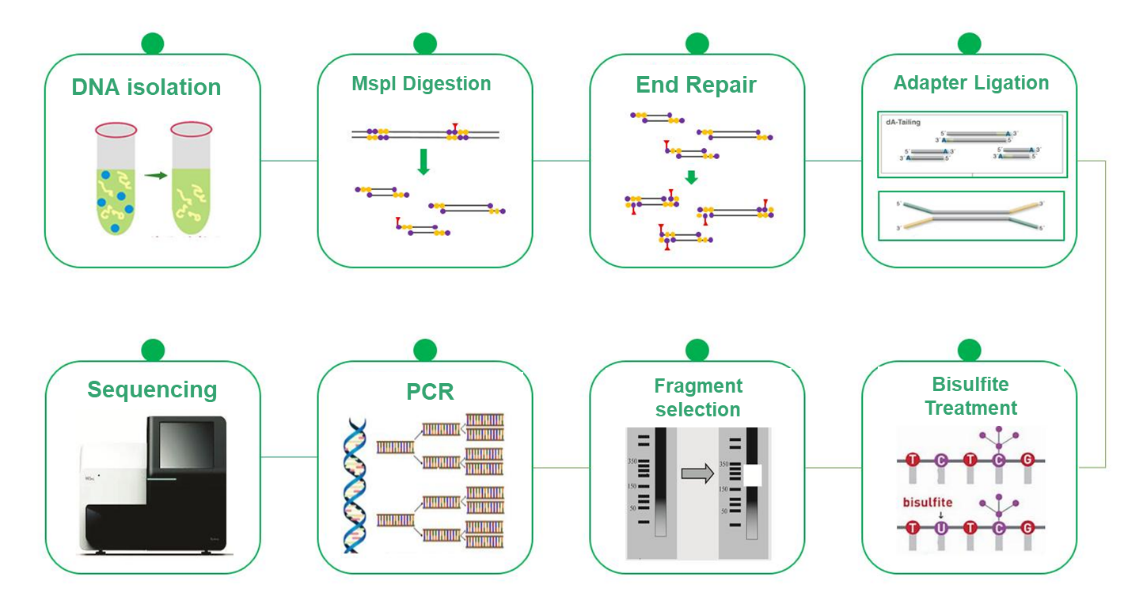
Bisulfit-Sequenzierung mit reduzierter Repräsentation (RRBS)
Die reduzierte Bisulfit-Sequenzierung (RRBS) hat sich in der DNA-Methylierungsforschung als kostengünstige und effiziente Alternative zur Bisulfit-Sequenzierung des gesamten Genoms (WGBS) herausgestellt. Während WGBS durch die Untersuchung des gesamten Genoms mit Einzelbasenauflösung umfassende Erkenntnisse liefert, können die hohen Kosten ein limitierender Faktor sein. RRBS mildert diese Herausforderung strategisch durch die selektive Analyse eines repräsentativen Teils des Genoms. Diese Methode beruht auf der Anreicherung von CpG-Insel-reichen Regionen durch MspI-Spaltung und anschließender Größenauswahl von 200-500/600-bps-Fragmenten. Folglich werden nur Regionen in der Nähe von CpG-Inseln sequenziert, während diejenigen mit entfernten CpG-Inseln von der Analyse ausgeschlossen werden. Dieser Prozess ermöglicht in Kombination mit der Bisulfit-Sequenzierung einen hochauflösenden Nachweis der DNA-Methylierung, und der Sequenzierungsansatz PE150 konzentriert sich speziell auf die Enden der Inserts und nicht auf die Mitte, wodurch die Effizienz der Methylierungsprofilierung erhöht wird. Das RRBS ist ein unschätzbar wertvolles Werkzeug, das eine kostengünstige DNA-Methylierungsforschung ermöglicht und das Wissen über epigenetische Mechanismen erweitert.