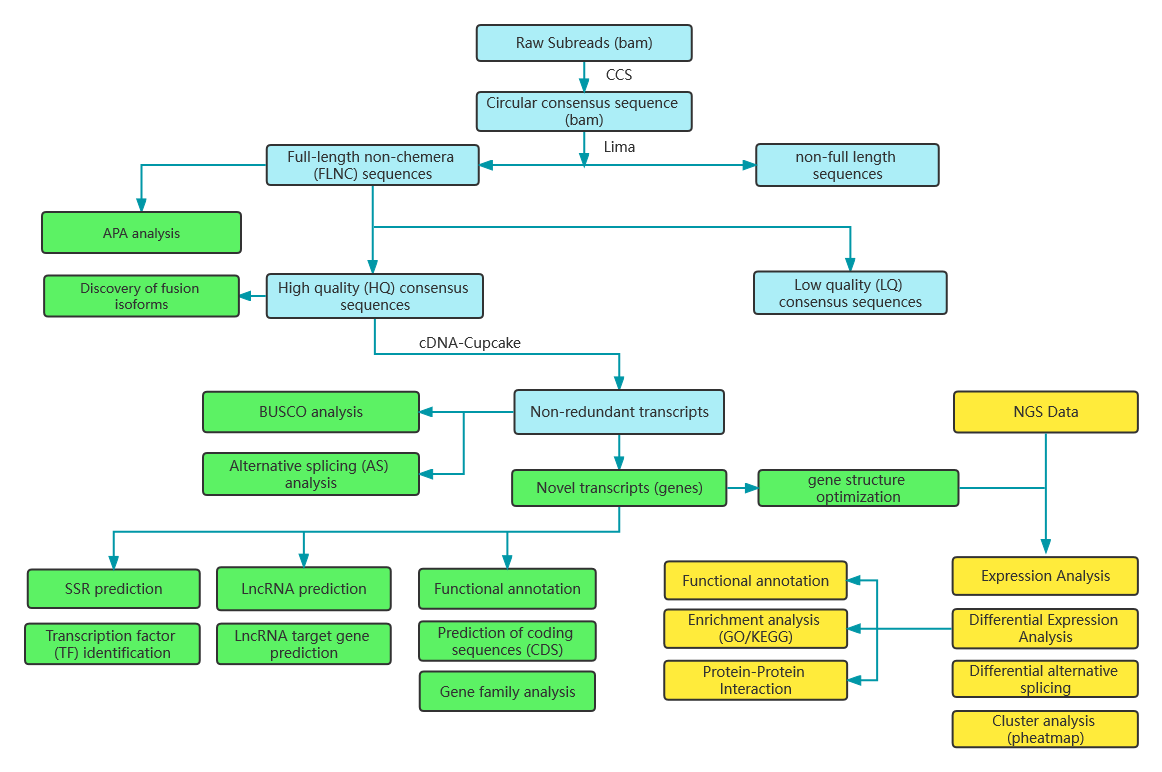
PacBio 2+3 Volllängen-mRNA-Lösung
Merkmale
● Studiendesign:
Mit PacBio sequenzierte gepoolte Probe zur Identifizierung von Transkript-Isoformen
Separate Proben (Replikate und zu testende Bedingungen) sequenziert mitNGS zur Quantifizierung der Transkriptexpression
● PacBio-Sequenzierung im CCS-Modus, wodurch HiFi-Reads generiert werden
● Sequenzierung der vollständigen Transkripte
● Für die Analyse ist kein Referenzgenom erforderlich; es kann jedoch eingesetzt werden
● Die bioinformatische Analyse umfasst nicht nur die Expression auf Gen- und Isoformebene, sondern auch die Analyse von lncRNA, Genfusionen, Polyadenylierung und Genstruktur
Vorteile
● Hohe Genauigkeit: HiFi liest mit einer Genauigkeit von >99,9 % (Q30), vergleichbar mit NGS
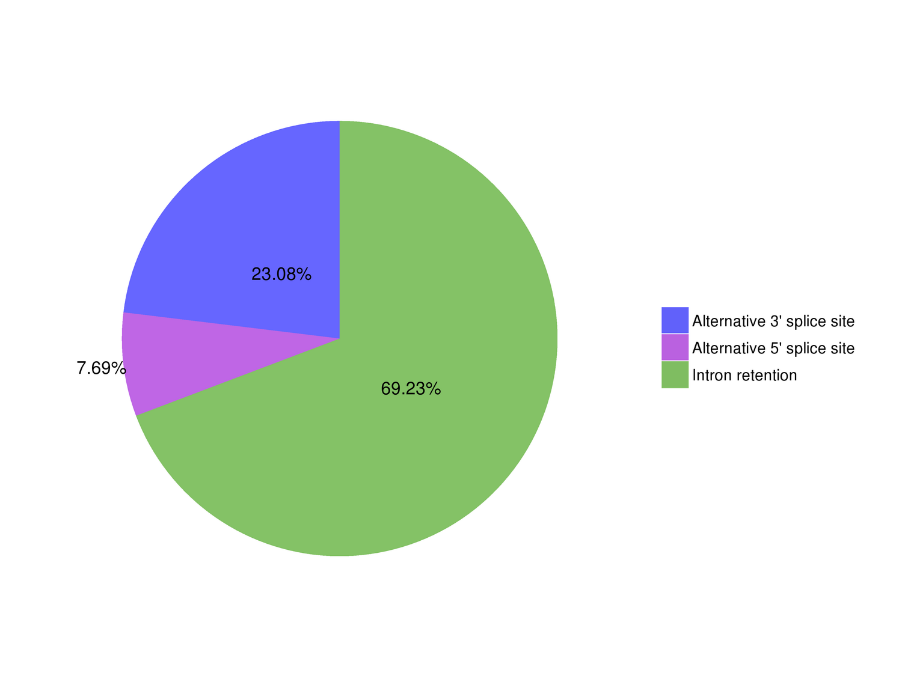
● Alternative Spleißanalyse: Die Sequenzierung aller Transkripte ermöglicht die Identifizierung und Charakterisierung von Isoformen.
● Kombination der Stärken von PacBio und NGS: Ermöglicht die Quantifizierung der Expression auf Isoformenebene und deckt Veränderungen auf, die bei der Analyse der gesamten Genexpression möglicherweise maskiert werden
● Umfangreiches Fachwissen: Mit einer Erfolgsbilanz bei der Durchführung von über 1100 PacBio-Transkriptomprojekten in voller Länge und der Verarbeitung von über 2300 Proben bringt unser Team einen großen Erfahrungsschatz in jedes Projekt ein.
● Post-Sales-Support: Unser Engagement geht über den Projektabschluss hinaus und umfasst einen dreimonatigen Kundendienstzeitraum. Während dieser Zeit bieten wir Projektnachverfolgung, Unterstützung bei der Fehlerbehebung und Frage-und-Antwort-Sitzungen an, um alle Fragen zu den Ergebnissen zu beantworten.
Musteranforderungen und Lieferung
| Bibliothek | Sequenzierungsstrategie | Daten empfohlen | Qualitätskontrolle |
| Mit PolyA angereicherte mRNA-CCS-Bibliothek | PacBio Fortsetzung II PacBio Revio | 20/40 GB 5/10 M CCS | Q30≥85 % |
| Poly A angereichert | Illumina PE150 | 6-10 GB | Q30≥85 % |
Nukleotide
|
| Konz. (ng/μl) | Menge (μg) | Reinheit | Integrität |
| Illumina-Bibliothek | ≥ 10 | ≥ 0,2 | OD260/280=1,7-2,5 OD260/230=0,5-2,5 Begrenzte oder keine Protein- oder DNA-Kontamination auf dem Gel sichtbar. | Für Pflanzen: RIN≥4,0; Für Tiere: RIN≥4,5; 5,0≥28S/18S≥1,0; begrenzte oder keine Grundlinienhöhe |
| PacBio-Bibliothek | ≥ 100 | ≥ 1,0 | OD260/280=1,7-2,5 OD260/230=0,5-2,5 Begrenzte oder keine Protein- oder DNA-Kontamination auf dem Gel sichtbar. | Pflanzen: RIN≥7,5 Tiere: RIN≥8,0 5,0≥28S/18S≥1,0; begrenzte oder keine Grundlinienhöhe |
Empfohlene Musterlieferung
Behälter: 2 ml Zentrifugenröhrchen (Alufolie wird nicht empfohlen)
Probenbeschriftung: Gruppe+Replikation, z. B. A1, A2, A3; B1, B2, B3.
Lieferung:
1. Trockeneis:Die Proben müssen in Beutel verpackt und in Trockeneis vergraben werden.
2. RNAstable-Röhrchen: RNA-Proben können in RNA-Stabilisierungsröhrchen (z. B. RNAstable®) getrocknet und bei Raumtemperatur versendet werden.
Beinhaltet die folgende Analyse:
Qualitätskontrolle der Rohdaten
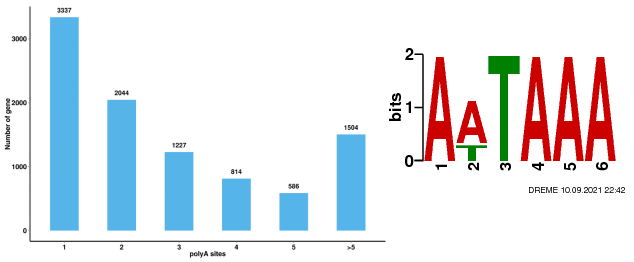
Alternative Polyadenylierungsanalyse (APA)
Analyse des Fusionstranskripts
Alternative Spleißanalyse
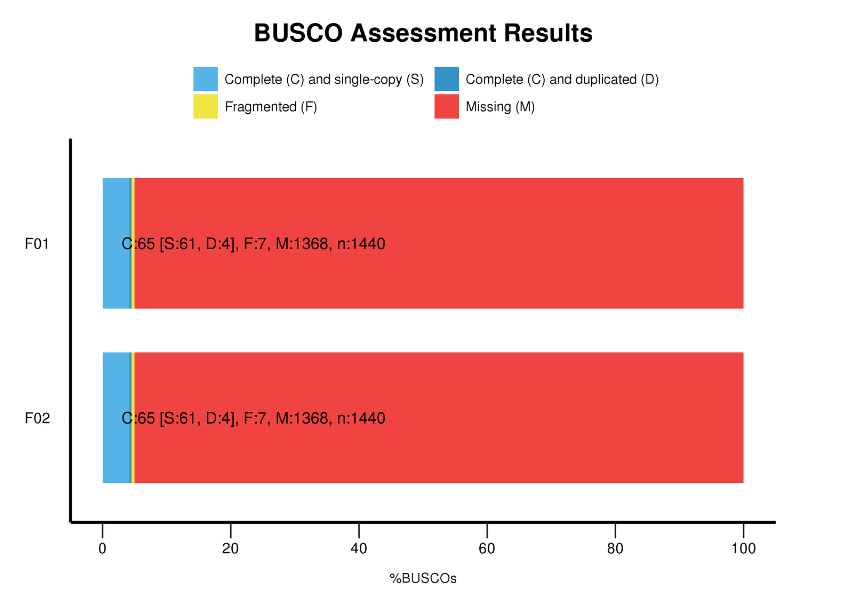
Benchmarking der Universal Single-Copy Orthologs (BUSCO)-Analyse
Neuartige Transkriptanalyse: Vorhersage kodierender Sequenzen (CDS) und funktionale Annotation
lncRNA-Analyse: Vorhersage von lncRNA und Zielen
MicroSatelite Identification (SSR)
Analyse differenziell ausgedrückter Transkripte (DETs).
Analyse differenziell exprimierter Gene (DEGs).
Funktionale Annotation von DEGs und DETs
BUSCO-Analyse
Alternative Spleißanalyse
Alternative Polyadenylierungsanalyse (APA)
Differenziell exprimierte Gene (DEGs) und Transkripte (DETs9-Analyse
Protein-Protein-Interaktionsnetzwerke von DETs und DEGs
Entdecken Sie die Fortschritte, die BMKGenes PacBio 2+3-mRNA-Sequenzierung in voller Länge ermöglicht, anhand einer kuratierten Sammlung von Veröffentlichungen.
Chao, Q. et al. (2019) „Die Entwicklungsdynamik des Populus-Stammtranskriptoms“, Plant Biotechnology Journal, 17(1), S. 206–219. doi: 10.1111/PBI.12958.
Deng, H. et al. (2022) „Dynamische Veränderungen des Ascorbinsäuregehalts während der Fruchtentwicklung und -reifung von Actinidia latifolia (einer ascorbatreichen Obstpflanze) und die damit verbundenen molekularen Mechanismen“, International Journal of Molecular Sciences, 23(10), S. 5808. doi: 10.3390/IJMS23105808/S1.
Hua, X. et al. (2022) „Effektive Vorhersage von Genen für den Biosyntheseweg, die an bioaktiven Polyphyllinen in Pariser Polyphylla beteiligt sind“, Communications Biology 2022 5:1, 5(1), S. 1–10. doi: 10.1038/s42003-022-03000-z.
Liu, M. et al. (2023) „Combined PacBio Iso-Seq and Illumina RNA-Seq Analysis of the Tuta absoluta (Meyrick) Transcriptome and Cytochrome P450 Genes“, Insects, 14(4), p. 363. doi: 10.3390/INSECTS14040363/S1.
Wang, Lijun et al. (2019) „Eine Untersuchung der Transkriptomkomplexität mithilfe der PacBio-Einzelmolekül-Echtzeitanalyse in Kombination mit der Illumina-RNA-Sequenzierung für ein besseres Verständnis der Ricinolsäure-Biosynthese in Ricinus communis“, BMC Genomics, 20(1), S. 1–17. doi: 10.1186/S12864-019-5832-9/FIGURES/7.